Co wiemy o pierwszym rosyjskim leku na koronawirusa
Zdrowie / / December 29, 2020

N + 1 - popularnonaukowa wydanie o tym, co dzieje się obecnie w nauce, inżynierii i technologii.
Pierwszy rosyjski lek na koronawirusa „Avifavir” uzyskał zgodę Ministerstwa Zdrowia. Twórca leku obiecuje, że pierwsze partie leku wyśle do szpitali 11 czerwca. Dowiemy się, skąd się wzięły te żółte pigułki, na jakiej zasadzie działa lek, co kliniczne przeszedł już testy i czy można z całą pewnością stwierdzić, że mamy lekarstwo COVID-19.
Skąd to się wzieło
Avifavir to nazwa handlowa rosyjskiego leku opracowanego przez Rosyjski Fundusz Inwestycji Bezpośrednich (RDIF) i grupę spółek ChemRar. Jednak aktywny składnik leku nie został wynaleziony w Rosji.
Jego międzynarodowa niezastrzeżona nazwa to favipiravir. Opracowany przez pracowników japońskiej firmy Toyama ChemicalToyama Chemical Co Ltd. - spółka zależna FUJIFILM Pharmaceuticals Corporation.
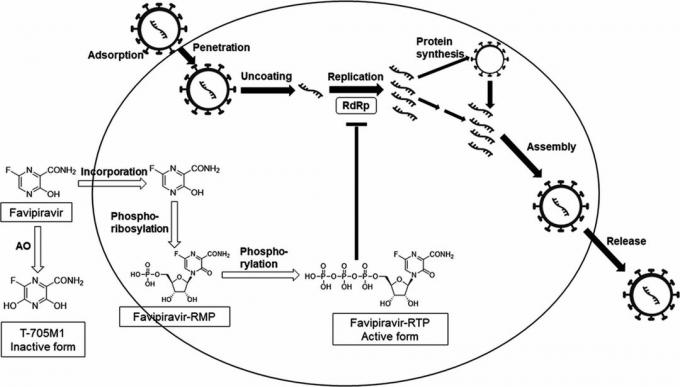
Ze względu na swoją budowę chemiczną fawipirawir jest pochodnąFavipiravir 6 - fluoro - 3 - okso - 3,4 - dihydropirazyno - 2 - kwas karboksylowy lub pirazynokarboksyamid. Podczas przeglądu biblioteki chemicznej pracownicy Toyamy odkryli, że substancja ta może mieć działanie przeciwko wirusowi grypy: komórki zakażone wirusem, fawipirawir jest przekształcany w aktywowaną postać, która hamuje aktywność ważnego enzymu wirusowego, polimerazy RNA zależnej od RNA
Choroba koronawirusa 2019 (COVID-19): Postępowanie u hospitalizowanych dorosłych.Jeśli polimeraza RNA zostanie wyłączona, wirusy grypy tracą zdolność drukowania swojego materiału genetycznego, RNA, w zakażonych komórkach. W rezultacie produkcja wirusa, który już dostał się do komórek, zatrzymuje się. Na tym polega wyjątkowość leku - zwykle leki przeciwwirusowe mogą jedynie zapobiegać przedostawaniu się wirusów do komórek.
Polimeraza RNA zależna od RNA występuje nie tylko w wirusach grypa, ale także we wszystkich wirusach RNA. Ponadto domena katalityczna polimerazy RNA - tak nazywa się część cząsteczki, dzięki której enzym w zasadzie może działać - ma taką samą strukturę we wszystkich wirusach RNA. A ponieważ fawipirawir wiąże się dokładnie z domeną katalityczną polimerazy RNA, Japończycy mieli powód, aby uważać tę substancję za środek przeciwwirusowy o szerokim zakresieFavipiravir (T - 705), inhibitor o szerokim spektrum działania wirusowej polimerazy RNA spektrum działania.
Pracownicy firmy Toyama zarejestrowali favipiravir pod marką Avigan i rozpoczęli badanie działania obiecującego leku na wirusy RNAFavipiravir (T - 705), nowy wirusowy inhibitor polimerazy RNA: od wirusów grypy A i B po Ebola. Wyniki były mieszane. Na przykład w przypadku wirusa Ebola okazało się, że lek działa na małpySkuteczność przeciwwirusowa fawipirawiru przeciwko wirusowi Ebola: badanie translacyjne na makakach cynomolgus, ale po zastosowaniu na ludziach wynikCzasy przeżycia uległy wydłużeniu u pacjentów z Ebolą leczonych fawipirawirem nie był zbyt imponujący. Z jednej strony śmiertelność u 73 pacjentów z Gwinei leczonych fawipirawirem była niższa niż u pacjentów, którzy próbowali uzdrawiać w inny sposób. Z drugiej strony różnica nie była aż tak duża: 42,5 proc. W porównaniu do 57,8 proc. - czyli niemożliwe upewnić się, że nie jest to tylko przypadkowy artefakt liczenia związany z faktem, że próbka pacjentów była bardzo mały. Niemniej jednak rząd Gwinei wyraził zgodęJaponia wysyła fawipiravir leku przeciw grypie Fujifilm do ponad 40 krajów w celu przeprowadzenia badań Covid-19 lek ten jest stosowany jako standardowe leczenie wirusa Ebola.
W ojczyźnie narkotyku, w Japonii, Avigan odniósł sukces zarejestrować dopiero w 2014 roku - i tylko przeciwko nowym szczepom wirusa grypy. Avigan nie był stosowany przeciwko grypie sezonowej.

Ponadto lek został zatwierdzony nie tylko przeciwko „nowej” grypie, ale wyłącznie w sytuacjach, gdy istniejące leki przeciwwirusowe były nieskuteczne - czyli w ostateczności. Przez sześć lat od momentu zatwierdzenia taka sytuacja nie zaistniała ani razu, więc w warunkach prawdziwej epidemii grypy lek nigdy nie był stosowany.
Przegląd 29 badań klinicznych (4299 uczestników), z których sześć stanowiły badania fazy 2 i 3 (już oceniane) skuteczność leku) wykazał, że fawipirawir „wykazuje korzystny profil bezpieczeństwa”: odsetek poważnych skutków ubocznych składający sięPrzegląd bezpieczeństwa fawipirawiru - potencjalne leczenie pandemii COVID-19? 0,4 proc. Wciąż problemy z bezpieczeństwem lek wciąż pozostaje.
Podkreślili japońscy naukowcy badający perspektywy stosowania leku w przypadku ciężkiej grypyFavipiravir, lek przeciw grypie przeciwko zagrażającym życiu zakażeniom wirusem RNAże Avigan jest przeciwwskazany u kobiet w ciąży: lek miał działanie teratogenne i embriotoksyczne na zwierzęta. Inne możliwe problemyFavipiravir (Stany Zjednoczone: niedostępny w handlu; patrz Ograniczenia dotyczące przepisywania i dostępu): Informacje o lekach: zmniejszony apetyt, nudności, wymioty, zwiększone stężenie kwasu moczowego we krwi (hiperurykemia) i uszkodzenie wątroby.
Czytam teraz🔥
- Konsekwencje koronawirusa mogą trwać przez całe życie. Oto, co o nim wiadomo
Favipiravir i COVID-19
W marcu 2020 roku Zhang Xinmin, dyrektor Narodowego Centrum Rozwoju Biotechnologii, które jest częścią chińskiego Ministerstwa Zdrowia, powiedziałFavipiravir wykazuje dobrą skuteczność kliniczną w leczeniu COVID-19: oficjalneże fawipirawir „wykazał dobrą skuteczność kliniczną przeciwko nowej chorobie koronawirusowej (COVID-19)”. Według danychEksperymentalne leczenie Favipiravirem dla COVID - 19: Otwarte badanie kontrolne co najmniej jedno otwarte, nierandomizowane badanie, 35 chińskich pacjentów z koronawirusem leczonych fawipirawirem (w badaniu nie mówiono o który lek był omawiany - oryginalny Avigan lub chiński lek z tą samą substancją czynną), wyzdrowiał szybciej i miał mniej powikłań niż 45 pacjentówktórzy byli leczeni innymi lekami (lopinawirem i rytonawirem).
Obecnie trwa ocena skuteczności leku przeciwko COVID-19Choroba koronawirusa 2019 (COVID-19): Postępowanie u hospitalizowanych dorosłych w badaniach klinicznych w Japonii. 9 kwietnia ogłoszono FUJIFILMFujifilm ogłasza rozpoczęcie badania klinicznego II fazy leku przeciwwirusowego „Avigan®” leku przeciw grypie dla pacjentów z COVID-19 w USA na początku drugiej fazy badań klinicznych Avigan, która odbędzie się w Stanach Zjednoczonych, w badaniu weźmie udział 50 pacjentów z chorobą koronawirusa. Według niektórych danych zagranicznych, w okresie kwiecień-maj, fawipirawir był testowany w 16 kolejnych badaniach klinicznych, ale w żadnym zakończone badanie kliniczne wykazujące skuteczność fawipirawiru lub Avigan przeciwko koronawirusowi choroba, nie.
Rosyjski lek
Każdy lek składa się z substancji czynnej i wypełniacza (gotowej postaci dawkowania). Rosyjski lek przeciwwirusowy zawiera ten sam aktywny składnikPierwszy rosyjski lek przeciwko koronawirusowi uzyskał zgodę Ministerstwa Zdrowiajako lek japoński - czyli 200 miligramów fawipirawiru na tabletkę. Jak w rozmowie z „N + 1” wskazanej przez przedstawiciela RDIF Arseny Palagin, wypełniacz rosyjskiego narkotyku jest jego własny. Instrukcje mówią, że substancje pomocnicze obejmują celulozę mikrokrystaliczną, kroskarmelozę sodową, koloidalny dwutlenek krzemu, stearynian magnezu i powidon K-30. Okres ochrony patentowej oryginalnego japońskiego Avigan wygasł w 2019 roku, więc lek można uznać za legalnie wyprodukowany. ogólny.
Rosyjskie badania kliniczne Avifaviru również nie zostały jeszcze zakończone. Ukończono tylko pierwszy i drugi etap wieloośrodkowego randomizowanego badania, potwierdza rozmówca „N + 1” z RDIF. W pierwszym etapie uczestniczyło 60 osób - 20 z nich znajdowało się w grupie kontrolnej, którą leczono standardowymi metodami. Nie ujawniono danych dotyczących składu wieku i ciężkości stanu badanych.
Oto, co zostało zgłoszoneRDIF i ChemRar Group of Companies dostarczy w czerwcu do rosyjskich szpitali 60000 kursów Avifaviru, pierwszego leku zarejestrowanego w Federacji Rosyjskiej przeciwko COVID-19 sami programiści o wynikach tych testów:
- nowe skutki uboczne oprócz tych, które Japończycy odnotowali wiele lat temu, nie ujawniły;
- po czterech dniach leczenia u 65 procent osób z grupy eksperymentalnej test koronawirusa dał wynik negatywny (w grupie kontrolnej takich przypadków było około 30 proc.);
- po trzech dniach 68 procent osób w grupie eksperymentalnej wróciło do normalnej temperatury (w grupie kontrolnej miało to miejsce szóstego dnia).
Ministerstwo Zdrowia zatwierdziło rozpoczęcie trzeciej fazy testów „Avifavir” 1 maja 2020 roku. Na tym etapie, zgodnie z danymiPaństwowy rejestr leków na stronie Państwowego Rejestru Leków będzie musiało wziąć udział łącznie 390 osób. Te same dane pokazują, że fawipirawir jest testowany przez dwie kolejne rosyjskie firmy: Drugs Technology (część grupy R-Pharm) i Promomed. Obie firmy rozpoczęły testy pod koniec maja.
Chociaż badania nie zostały zakończone i znane są tylko częściowe dane na temat skuteczności, Ministerstwo Zdrowia zezwoliło na wczesną rejestrację leku - zgodnie z przyspieszoną procedurą przyjętą na mocy rozporządzenia.Uchwała Rządu Federacji Rosyjskiej z 3 kwietnia 2020 r. Nr 441 Rząd Federacji Rosyjskiej z 3 kwietnia 2020 r. Nr 441. Dekret ten mówi, że „zmniejszenie liczby badań <...> jest dopuszczalne” w warunkach zagrożenia powstaniem i likwidacją nagły wypadek».
Więc producent już obiecujeRDIF i ChemRar Group of Companies dostarczy w czerwcu do rosyjskich szpitali 60000 kursów Avifaviru, pierwszego leku zarejestrowanego w Federacji Rosyjskiej przeciwko COVID-19 do końca przyszłego tygodnia przynieś pierwsze partie tabletek do szpitali.
W instrukcjachInstrukcje dotyczące medycznego stosowania leku „Avifavir” do leku jest napisane, że został on „przygotowany na podstawie ograniczonej ilości danych klinicznych dotyczących stosowania leku i będzie uzupełniany, gdy pojawią się nowe dane”. Jednak przeciwwskazania zostały już zidentyfikowane. Podobnie jak w przypadku japońskiego Avigan, jest to planowanie ciąży, ciąża i okres karmienia piersią - generyczny jest również potencjalnie teratogenny. Pacjenci z dną moczanową i hiperurykemią powinni stosować lek z ostrożnością. Ponadto listę przeciwwskazań do rosyjskiego leku generycznego uzupełniono nadwrażliwością na substancję czynną, wiek do 18 lat, ciężką niewydolnością wątroby i nerek.
Lek nie będzie dostarczany do aptek: zgodnie z instrukcją lek może być stosowany tylko w szpitalach.
Jaki jest wynik
Avifavir jest lekiem generycznym Favipiraviru, który ma odrębny mechanizm działania i przechodzi badania kliniczne w Rosji i za granicą.
Wyniki tymczasowych badań klinicznych pokazują, że lek jest obiecujący: na tych małych próbki, które udało im się sprawdzić, efekt terapeutyczny, sądząc po wypowiedziach twórców, do ustalenia udało się. Ale dopóki badania kliniczne nie zostaną zakończone, a wyniki zostaną opublikowane w recenzowanym czasopiśmie czasopismach międzynarodowych, nie możemy być całkowicie pewni, że Avifavir naprawdę pomaga w walce z koronawirusem choroba. Serwis prasowy ChemRar, twórcy leku, nie odpowiedział na pytania N + 1 w momencie publikacji tego tekstu.
Teraz nie mamy leków, które celowo i skutecznie działałyby przeciwko wirusowi SARS - CoV - 2. Wszystkimi pretendentami do tego tytułu są teraz substancje znane przed pojawieniem się nowego koronawirusa, które w praktyce klinicznej testy (które właśnie się rozpoczęły) konsekwentnie wykazują pewien pozytywny efekt z wieloma ograniczenia. W tej chwili jest ich dwóch.
Pierwszym z nich jest Remdesivir, który trafił na pierwsze strony w maju, lek, który jeszcze przed epidemią COVID-19 miał leczyć innego koronawirus infekcja, Zespół oddechowy na Bliskim Wschodzie (MERS). Amerykański regulator zatwierdził kliniczne zastosowanie Remdesivir bez czekania na formalne zakończenie badania leków, - obecność stabilnego efektu we wstępnych danych badawczych przekonała medycznego urzędnicy. Porównano tę sytuacjęWszystkie oczy skierowane na Gilead z wczesną rejestracją AZTZydowudyna, pierwsze lekarstwo na HIV.
Jednocześnie „Remdesivir” nigdy nie uzyskał statusu „srebrnej kuli”: testy pokazująRemdesivir do leczenia Covid-19 - raport wstępnyże nie może pomóc osobom z ciężkimi objawami - które wymagają mechanicznej wentylacji płuc, a dla tych z łagodniejszymi objawami skraca czas choroby o cztery dni. W badaniach tych nie wykazano istotności statystycznej wielu innych skutków - na przykład zmniejszenia śmiertelności z powodu tej choroby w porównaniu z innymi lekami. Próbka badań Remdesivir, które zostały zgłoszone pod koniec maja przez New England Journal of Medicine, liczyła 1059 osób.
Elena Verbitskaya
Kierownik Zakładu Statystyki Biomedycznej Państwowego Uniwersytetu Medycznego w Petersburgu im. Akademika I. P. Pavlova.
60 przedmiotów - czy to dużo czy mało?
Liczbę osób potrzebnych do przetestowania skuteczności leku oblicza się za pomocą specjalnych wzorów, które uwzględniają wiele zmiennych: na przykład cechy wskaźników, które mają być brane pod uwagę, ich rozrzut, poziom odchylenia od wskaźników grupy kontrolnej, który zostanie rozpatrzony klinicznie znaczący.
Przypisywane są wskaźniki, które będą brane pod uwagę podczas testów. Głównym z nich jest zwykle śmiertelność. W przypadku infekcji dróg oddechowych stosuje się wskaźniki integralne, które uwzględniają np. Liczbę dni z gorączką, czas przebywania na oddziale intensywnej terapii lub oddziale intensywnej terapii, wentylację mechaniczną i kaszel. Wszystkie z nich są przeliczane na punkty według określonej formuły, a następnie punkty grupy eksperymentalnej są porównywane z punktami grupy kontrolnej.
Do niektórych badań wystarczy 20 tematów. Dla niektórych 2000 to za mało.
Badania pilotażowe na małej grupie można przeprowadzić przed badaniami klinicznymi. Nierzadko zdarza się, że efekt stwierdzony w grupie kilkudziesięciu osób następnie „eroduje” w dużych grupach.
Favipiravir, podobnie jak Remdesivir, nie został pierwotnie opracowany jako środek przeciwko nowemu koronawirusowi. Lek wiele lat temu - do tego stopnia, że wygasł już na niego patent - został przystosowany do leczenia grypy (zupełnie nowe wirusy, a nie choroby sezonowe) i przebadany na wirusy Ebola i Zika.
Tak, wydaje się, że rosyjscy naukowcy dostrzegli efekt jego zastosowania w leczeniu COVID-19 - ale jak dotąd na małej próbie 60 osób nie ma szczegółowych informacji na temat metod selekcji i ich składu.
Więc wydaje się, że mamy pigułki. Aby upewnić się, że to naprawdę lekarstwo, będziesz musiał trochę poczekać.

Koronawirus. Liczba zarażonych:
6 661 888
na świecie441 108
w RosjiPrzeczytaj także🦠
- Jak długo potrwa odporność na nowego koronawirusa?
- 6 sztuczek, które tak naprawdę nie zapobiegają zarazkom
- Jak mogą wyglądać nowe fale pandemii



